艾滋病(获得性免疫缺陷综合征,AIDS)自 1981年在美国首次报告以来,其在全球流行已导致3900 万人死亡,是人类面临的严重公共卫生和社会问题。虽然高效抗逆转录病毒治疗(HAART)能有效抑制病毒的复制,提高患者的生存时间和生存质量,使艾滋病成为一种可控的慢性感染性疾病,但HAART治疗不能彻底治愈艾滋病,因为艾滋病毒感染早期即能够在静息记忆性CD4+T细胞、单核细胞、巨噬细胞及滤泡树突状细胞等形成病毒储存库,目前的HAART疗法无法清除储存库,患者需终身服药,一旦停药储存库中的潜伏病毒即重新激活,迅速出现病毒反弹,这是艾滋病治愈的巨大挑战。
安全有效的艾滋病疫苗是预防艾滋病毒传播的迫切需求,然而,艾滋病困扰人类已三十余年,由于病毒变异大,病毒包膜蛋白表面高度糖基化和构象遮蔽阻止中和表位识别,加之对艾滋病毒感染的免疫保护机制缺乏清晰认识等,至今尚无可供预防使用的有效艾滋病疫苗问世。诱导产生能中和不同亚型病毒的广谱中和抗体是有效疫苗的重要目标,虽然现在还没有研发出能诱导产生广谱中和抗体应答的艾滋病疫苗,但多年的研究已经发现,在艾滋病毒自然感染过程中,有部分感染者能够产生针对膜蛋白保守区的广谱中和抗体,这些广谱中和抗体一般在病毒感染后2-3年出现,能以极低浓度中和大部分艾滋病毒株,对这些广谱中和抗体的分离鉴定及其产生机制的探索可为有效艾滋病疫苗设计提供科学依据。
近年来,随着高通量中和抗体筛选和单克隆抗体分离技术的进步和广泛应用,已经从感染者成功分离出上百个广谱中和抗体。对这些广谱中和抗体的识别表位进行鉴定发现,艾滋病毒包膜蛋白上存在几个主要的广谱中和表位区(图1),分别为病毒包膜蛋白gp120 上保守的 CD4 结合位点(CD4bs):b12、NIH45-46、VRC01、VRC07 及 3BNC117 等为针对此区域的广谱中和抗体;V1V2聚糖区(V1V2-glycan):PG9、PG16、PGT141-145、CH01-04 及 PGDM1400等为针对此区域的广谱中和抗体;V3聚糖区(V3-glycan):PGT121-123、PGT125-131、PGT135、10-1074 和2 G12等为针对此区域的广谱中和抗体;gp120-gp41 交界面(gp120-gp41 interface):35O22、PGT151 和 8ANC195等为针对此区域的广谱中和抗体;gp41上的近膜端外部区域(menbrane proximal externalregion ,MPER):这是包膜蛋白 gp41 上的一个高度保守区域,对病毒融合过程至关重要,针对此区域的中和抗体包括 4E10、2F5 和 10E8 等[1]。
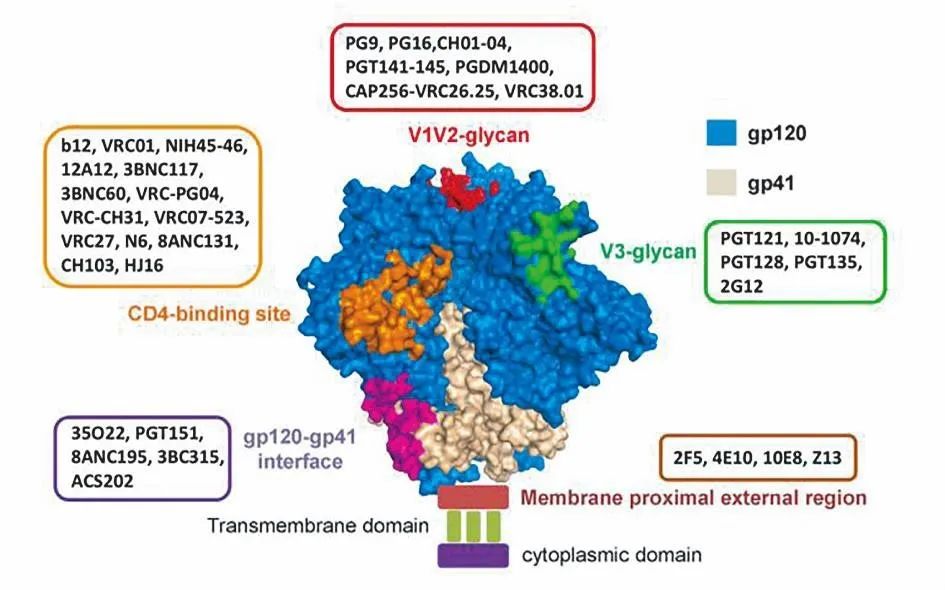
图1. 膜蛋白上的中和表位区及代表性广谱中和抗体[1]
广谱中和抗体及其识别表位的筛选鉴定为利用反向疫苗学技术进行艾滋病疫苗研发提供了重要基础,能够产生广谱中和抗体的感染者可作为潜在的通过疫苗诱导相似中和抗体的模型,通过模仿广谱中和抗体在机体内与病毒共进化及亲和力成熟过程,使用不同的天然膜蛋白进行序贯接种,以结合并激活广谱中和抗体的未突变共同祖细胞,促使特异性前体B细胞分化成熟为分泌广谱中和抗体的浆细胞(图2),实现通过疫苗接种诱导产生广谱中和抗体的目的[2]。
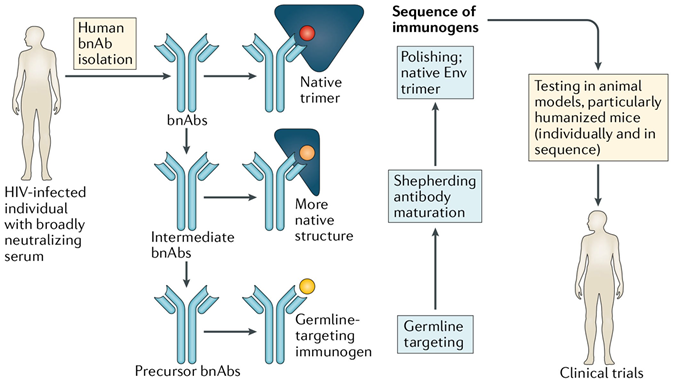
图2. 基于序贯免疫策略诱导广谱中和抗体应答的模式图[2]









