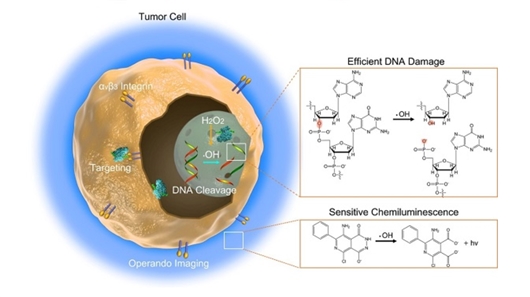
人工金属酶切割肿瘤细胞DNA及实时动态监测抗肿瘤治疗效果示意图。图片来源:《科学进展》
人工金属酶作为一种潜在的分子药物,有望在人体内靶向治疗癌细胞,减少癌症治疗副作用。但未搞清内部催化机制时,其应用就显得有些束手束脚。
本月,北京工业大学和中科院高能物理所联合的研究团队在《科学进展》上报告了一项研究,他们阐明了一种人工金属酶的精细分子结构和能级分布特征,并揭示了这种仿生酶的催化活性机制。
天然酶有高效的催化性能,但生物医学中的应用对酶的稳定性和免疫原性有更高要求。为此,研究者对酶进行了一系列改造,使其得以在更多生物反应中施展拳脚。
在新发表的研究中,科学家设计出活性中心为铜团簇的人工金属酶,辅以肿瘤靶向肽和血清白蛋白——前者帮助酶与肿瘤细胞定向结合,后者让酶更稳定、活性更高。为血清白蛋白换上金属团簇内核后,其生物兼容性和金属催化能力都有所改良。
经过一系列计算和实验,科学家发现,这种人工金属酶与底物匹配度良好。而且,由于自身独特的几何形状,人工金属酶在肿瘤微环境中可长期、稳定、选择性地让过表达的过氧化氢转化,使其变为羟基自由基和氧气。羟基自由基既能持续切割肿瘤细胞的DNA,让治疗更高效,还能产生灵敏的化学发光,便于人们动态追踪疗效。
研究团队还发现,随着催化反应的进行,人工金属酶的活性中心并不会损耗,因为团簇的金属价态实现了封闭式周期性循环,确保反应更稳定、持续。
这项研究意味着人工金属酶的合成向精准按需又迈进一步。此外,金属团簇独特的催化动力学和稳定性构造出新的反应路径,帮助人们建立可视化检测、高效治疗特定肿瘤的新方法。










